| Medusmaize, tik tiešām! |
Apr. 29th, 2015|12:45 am |
Sākās ta diena, kā diena - atradās kārtējais murgojums par sārmaino organismu. Iekš Tvnet jaunās sadaļas "Egoiste" (sadaļas saturs kopumā tāds pats, kā sadaļai "Sievietēm", tikai ar pamatīgu tendenci uz stulbumu). Par šo tēmu esmu izteicies iepriekš, un man jau sāk mazliet tā kā apnikt komentēt, bet tomēr atradu arī ko jaunu un negaidītu, par ko klusēt nu vienkārši nevaru.
Stāv tur rakstīts, ka "Hroniskas paskābināšanās ietekmē taukskābju negatīvie lādiņi mainās uz pozitīviem, tādēļ tās pielīp pie artēriju sieniņām, palielinot diabēta un sirds slimību risku". Tik konkrētiem ķīmiskiem terminiem, melns uz balta - bet tā kā ne visi ir labi pazīstami ar organisko skābju ķīmiju, atļaušos ilustrēt to, par ko tad šeit ir runa:
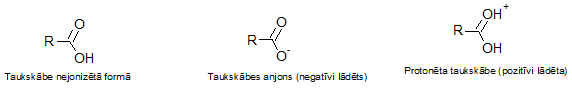
Taukskābju gadījumā burtiņa R vietā ir visai gara ogļūdeņražu aste, vienai taukskābei no otras šie fragmenti atšķiras ar, pirmkārt, garumu (t.i., to, cik oglekļa atomu ir saistījušies ķēdē), un otrkārt, ar to, kādas saites šos oglekļa atomus savā starpā savieno - ja visas ir vienkāršās saites, tad attiecīgo taukskābi pieskaita pie piesātinātajām, ja starp tām ir arī kāda dubultsaite vai vairākas, tad tā ir kāda no nepiesātinātajām taukskābēm. Tas gan ir mazsvarīgi konkrētajā gadījumā, jo visas lādiņu maiņas taukskābēm norisinās tieši attēlā redzamajā daļā - to sauc par karboksilgrupu.
Pa kreisi attēlota nejonizēta taukskābe - tā parasti pieraksta taukskābju (un arī citu karbonskābju) formulu. Tiesa, šādā formā taukskābes varētu būt nepolārā vidē - un ūdens vide (kāda ir mūsu organismā, piemēram), ir polāra. Tur skābes jonizējas. Un skābes tādēļ ir skābes, ka tās visai viegli atbrīvo pozitīvi lādētu ūdeņraža jonu (karbonskābju gadījumā - to, kurš ietilpst OH fragmentā), un atlikušais skābes fragments kļūst par negatīvi lādētu jonu (anjonu). Izņēmums varētu būt ļoti skāba vide - tajā jau ir tik liela pozitīvo ūdeņraža jonu koncentrācija, ka karbonskābe savējo atdot nespēj (vismaz formāli - reāli jau atdod gan, taču tikpat atri dabū citu vietā) Anjons attēlots turpat līdzās, un ir ļoti bieži sastopams fragments skābju šķīdumos ūdens vidē, pateicoties tam, ka atbrīvotais ūdeņraža jons spēj atgriezeniski saistīties ar ūdeni, turklāt skābes anjons gana viegli saistās arī ar citiem pozitīviem joniem (dažādu metālu katjoniem, piemēram). Un taisnības labad jāteic, ka brīvā formā taukskābes organismā nemaz tik bieži nav atrodamas (tās tur tiek transportētas saistītā formā kā triglicerīdi, un tiek atbrīvotas tikai noteiktos gadījumos, teiksim, lai izdabūtu cauri šūnu membrānām), taču jebkurā gadījumā, to anjons nav nekas eksotisks.
Nu, un var jau skābes arī iegūt pozitīvu lādiņu. Lai tas notiktu, karbonskābei ne vien jāsaglabā savs ūdeņraža atoms, bet papildus tam jāpiesaista viens "svešs" pozitīvs ūdeņraža jons. Struktūru uzzīmējis arī esmu, lai ilustrētu situāciju. Tā uzreiz no galvas nezināju, kādos apstākļos tad var veidoties šāds jons - protonēta karbonskābe ir visai reti sastopams zvērs. Droši tikai zināju, ka videi jābūt stipri skābai. Par laimi, eksistē skābju stipruma tabulas, un labākajās no tām var atrast arī to, cik tieši skābai. Te tiek lietots tāds lielums, kā pKa. Pārāk neiedziļināšos, teikšu tik, ka tas atbilst tādam pH (ekstrapolējot uz ūdens vidi), kurā attiecīgā skābe būtu par 50% disociējusi. Vai arī tā - jebkurš pH, kas mazāks par kādas skābes pKa vērtību, ir skābāks par to, un tāds, kas lielāks, attiecīgi, ir bāziskāks. Protonētās karbonskābes atrodas tuvu tabulas augšgalam, turpat, kur sālsskābe. To pKa ir ap -7. Tas nozīmē, ka tā ir apmēram 10^7 reizes stiprāka skābe, nekā ūdens vidē vispār varētu eksistēt - tā momentā protonētu ūdeni. Bet ja jums asinsvados sāktu plūst tīra sērskābe, tad jā, mierīgi. Tad visām jūsu taukskābēm būtu pozitīvs lādiņš. Tiesa, pie artēriju sieniņām tās diez vai pieliptu, jo nebūtu vairs tādu sieniņu - sērskābe tomēr nav nekāds joks, tā ir ļoti stipra neorganiska skābe. Ņemot vērā, ka līdz tādam asins skābumam cilvēkam aizdzīvoties nebūs iespējams, par pozitīvajām taukskābēm es atļaušos neuztraukties.
Ā, un beidzot atradu skaidrojumu tai citrona padarīšanai, vismaz pH diētas "speciālistu" izpratnē:
"Piemēram, lai gan citronu sula ir skāba, tā ķermeņa vidi padara sārmaināku, jo vielmaiņas procesā pārveidojas par bāzisku «citrātu»."
Un ja nu jums nav pa rokai citrona, nekrītiet izmisumā - droši pogājiet vaļā auto akumulatoru un tesiet tik iekšā. Bez bailēm, organismā sērskābe pārveidojas par bāzisku sulfātu. No lietām, kas vēl organismā tad pārveidojas, būtu minams rīkles dobums un barības vads, iesākumam. Bet nu, apgalvojums paliek ķīmiski korekts - sērskābe tik tiešām izveidos anjonu, kuru sauc par sulfātu (tāpat, kā citronskābes anjonu sauc par citrātu, bez pēdiņām). Un attiecīgais anjons pats par sevi pēc definīcijas ir bāziskāks par tam atbilstošo skābi, gan sērskābes, gan citronskābes gadījumā. Tas gan nemaina faktu, ka pirms kļūšanas par atbilstošo anjonu tā tomēr bija skābe, un lai kļūtu par anjonu, atdeva videi pozitīvi lādētu ūdeņraža atomu. Atšķirība starp abām šīm skābēm ir tā, ka sērskābe ir ļoti stipra skābe (atminamies, tās pKa = -9), un tādēļ spējīga savu ūdeņraža atomu momentā atdot da jebkam, kas par to ir jūtami bāziskāks (t.i., kā pKa ir lielāks par -9, kas organismā ir gluži vienkārši jebkas). Citronskābe ir švaka skābe, un organisma videi ūdeņraža atomu atdos nepilnīgi (proti, no visām citronskābes molekulām tikai kāda daļa, turlāt saglabāsies kaut kāds līdzsvars starp jonizēto un nejonizēto formu), rezultātā viegli pazeminot vides pH (ja tas jau tā nebūs aplam zems), atšķirībā no sērskābes, kas brutāli noprotonēs vienalga ko, un pat vārdu nepaprasīs, ne arī piedāvās kafiju iedzert... Tas gan faktu, ka abas ir skābes, nemaina, un no tā izriet, ka tās vides skābumu palielina, nevis samazina. Etiķskābe, piemēram, ir nedaudz švakāka skābe par citronskābi, un tā vides skābumu palielinās mazāk. Tālāk vielmaiņas procesā gan ar etiķskābes anjonu, gan citronskābes anjonu notiek šādas tādas pārmaiņas, taču neviena no tām, cik zinu, vidi bāzisku nepadara (ja kļūdos, lūgšu kādu zinošāku palabot - neizejot no bioloģijas rāmjiem ezotērikas virzienā, protams). Sērskābes anjonu gan pārāk interesanti piedzīvojumi negaida, bet nu, tas jau tā.
Lasot šo te sārmainās ēšanas rakstiņu, atminējos, ka tad, kad pēdējoreiz spriedelēju par tamlīdzīgu rakstu, mani ![[info]](http://klab.lv/img/userinfo.gif) metalpostcard uzcienāja ar linku uz līdzīgas tematikas ierakstu portālā medusmaize.lv. Konkrēti, tika minēts šitais te ieraksts. Toreiz nopriecājos, bet atliku izteikšanos uz vēlāku. Šodien gribēju atgriezties, taču iepriekš saņemtais links nestrādāja, un tā vietā nonācu citā tā paša portāla sadaļā. Un vēl vairāk sapriecājos. Bet nu, par visu pēc kārtas. Iesākumā tā pamazām pārskriešu (blēņas, kas nav ar ķīmiju saistītas, neapskatot) "sārmainajam" rakstam, turklāt necilāšu tās muļķības, kuras jau esmu apspriedis iepriekš citos, analoģiskos rakstos. Par laimi, te ir gana daudz jauna. Jau pašā iesākumā, kaut vai. metalpostcard uzcienāja ar linku uz līdzīgas tematikas ierakstu portālā medusmaize.lv. Konkrēti, tika minēts šitais te ieraksts. Toreiz nopriecājos, bet atliku izteikšanos uz vēlāku. Šodien gribēju atgriezties, taču iepriekš saņemtais links nestrādāja, un tā vietā nonācu citā tā paša portāla sadaļā. Un vēl vairāk sapriecājos. Bet nu, par visu pēc kārtas. Iesākumā tā pamazām pārskriešu (blēņas, kas nav ar ķīmiju saistītas, neapskatot) "sārmainajam" rakstam, turklāt necilāšu tās muļķības, kuras jau esmu apspriedis iepriekš citos, analoģiskos rakstos. Par laimi, te ir gana daudz jauna. Jau pašā iesākumā, kaut vai.
"Kā likums vesels bērns dzimst ar neitrālu bioloģisko vidi. Bērna organismā ir daudz negatīvi lādētu ūdeņraža jonu (H-), kuri neitralizē kaitīgos radikāļus un sekmē normālu bioloģisko reakciju norisi."
Atzīšos, šim teikumam, pirmo reizi lasot, pārlēcu pāri - automātiski, izlasot, ka ūdeņraža joni neitralizē radikāļus, pasmīnēju, un pa diagonāli lasīju tālāk. Tad smadzenes padeva trauksmi, un es atgriezos pie šī teikuma. Redz, pirmo reizi lasot, vārdu savienojumu "ūdeņraža joni" biju automātiski sapratis kā uz pozitīvajiem ūdeņraža joniem attiecinātu. Tas tāpēc, ka šie ir populārāki. Jebkura skābe (vismaz Bronsteda - t.i., vienkāršākajai, lai arī nepilnīgākajai skābju-bāzu teorijai atbilstošu - skābju gadījumā), pēc definīcijas, ir molekula vai jons, kas spēj videi atdot pozitīvi lādētu ūdeņraža jonu, savukārt bāze - daļiņa, kas spēj šādu pozitīvu ūdeņraža jonu pievienot. No tā izriet daudzi svarīgi secinājumi, piemēram, ka viela var būt gan skāba (attiecībā pret par sevi mazāk skābām vielām), gan bāziska (salīdzinot ar skābākām vielām) vienlaikus. Vispār, pozitīvie ūdeņraža joni (ķīmiķu žargonā saukti par protoniem, jo tā jau būtība arī sanāk - ūdeņraža atoma kodolā ir tikai viens protons, un tātad šajā atomā ir viens vienīgs elektrons, kuru atoms, kļūstot par pozitīvu jonu, zaudē) ķīmijā figurē ļoti, ļoti bieži, ir iesaistīti daudzos un dažādos procesos, un ar savu neizbēgamo klātbūtni tik daudzās vietās un lietās ir aizēnojuši savus negatīvi lādētos radiniekus.
Un tomēr, viņi eksistē.
Negatīvi lādētie ūdeņraža joni, saukti par hidrīdjoniem, lai arī sastopami salīdzinoši reti, ir gana pazīstami. Ūdeņraža atoms, lai gan viegli zaudē savu vienīgo elektronu, ar zināmu piespiešanos var arī vienu elektronu "adoptēt", kļūstot negatīvi lādēts. Viegli tas nenotiek - ar viena protona pozitīvo lādiņu knapi pietiek, lai abus elektronus noturētu šajā jonā. Tur sākas problēmas ar medusmaizes autora teoriju.
Kad man pirmoreiz nācās sastapt hidrīdjonu, biju otrā kursa students. Man bija jāveic reakcija, kurā nepieciešams jonizētā stāvoklī novest ļoti vāju skābi. Un, jo vājāka skābe, jo stiprāka bāze nepieciešama, lai skābei to nelaimīgo protonu atrautu. Un hidrīdjons ir ļoti stipra bāze. Tik stipra, ka es no priekšniekiem saņēmu tik rūpīgu drošības tehnikas instruktāžu, ka pat nedaudz sabijos (pirms tam drošības tehnikas instruktāžas bija apmēram tikpat bieža parādība kā vienradža pirdiens). Kā jau ar daudzām vielām, eventuāli sāku arī ar hidrīdjona donoriem rīkoties visai droši (tik droši, ka sanāca mazmazītiņš negadījumiņš, kas gan bija gana kluss, lai neviens nepamanītu). Bet viena lieta man tika piekodināta no paša sākuma. Hidrīdi (t.i., savienojumi, kas satur negatīvos ūdeņraža jonus) ārkārtīgi aktīvi reaģē ar ūdeni. Šitā ar ūdeni reaģē nātrija hidrīds. Un ne jau nātrija dēļ - nātrija hidrīdā nātrijs ir pozitīvi jonizēts, tāpat kā nātrija hlorīdā, kurš, kā zināms, ūdenī šķīst bez jebkādiem specefektiem. Vaininieks ir hidrīdjons, kurš, būdams ļoti spēcīga bāze, momentā atrauj pozitīvu ūdeņraža jonu no ūdens, veidojot gāzveida ūdeņradi. Šī reakcija notiek ar tik pamatīgu siltuma izdalīšanos, ka radies ūdeņradis acumirklī aizdegas. Saskaņā ar iepriekšminēto Bronsteda skābju-bāzu teoriju, nātrija hidrīds (kā jau jebkurš hidrīdjona avots) ir tik spēcīga bāze, ka ar to salīdzinājumā ūdens ir stipra skābe.
Un tā kā ikvienam skaidrs, ka vesela bērna organismā ir sastopams ūdens, un dzemdības parasti nenotiek ar liesmām vai eksplozijām, nu nebūs tajā nabaga bērniņa organismā negatīvi ūdeņraža joni. Nu nebūs. Un ja arī būtu, tie ar radikāļiem reaģētu štruntīgi - pirmkārt, radikāļi tomēr nav tik pozitīvi lādēti, lai būtu pirmie, ar ko hidrīdjoni reaģētu, otrkārt, reakcijas rezultātā hidrīdjons pats pārvērstos par radikāli (jo no diviem elektroniem tas radikālim spētu atdot tikai vienu, tā rezultātā zaudējot negatīvo lādiņu, taču saglabājot nesapārotu elektronu, kas ir bezmaz vai radikāļa definīcija). Blēņas, vienvārdsakot.
Tad seko čupa ar nepamatotiem apgalvojumiem, kuru ir bišku par daudz, lai tos aplūkotu. Atļāvos patīt uz priekšu līdz nodaļai par skābju un sārmu līdzsvaru.
"Asins pH nobīde uz skābo pusi veicina iekaisuma procesus, bet nobīde uz sārmaino pusi veicina ātrāku izveseļošanos, kā arī veicina pašatjaunošanās procesus."
http://en.wikipedia.org/wiki/Alkalosis
"Asinis ir sārmainas, turpretī limfa un starpšūnu šķidrums lielākajai daļai mūsdienu cilvēku ir skābi. Slimība biedrojas ar skābi, veselība ar bāzi."
Nekas īpaši interesants, tikai gribēju šeit piebilst, ka nē, visi kaut cik ar reālu medicīnu saistītie avoti gan limfu, gan starpšūnu šķidrumu sauc par bāziskiem.
"Skābā vidē veidojas daudz brīvo radikāļu, kas bojā šūnu membrānas, kā arī DNS un RNS struktūras, radot mutācijas šūnu līmenī, kas draud ar šūnas pārprogrammēšanu."
Savādi gan, jo grāmatas "Brīvo radikāļu ķīmija" nodaļā par brīvo radikāļu iegūšanas veidiem skābes nefigurē.
"Skābā vidē skābekļa atomi ir saistītā stāvoklī. Tāpēc mūsu šūnām, nav ko elpot. Arī biežāku elpošanu mēs maz ko līdzēsim. Skābekli var atbrīvot tikai sārmainie mikroelementi (kalcijs, magnijs, nātrijs, kālijs)."
Grūti pateikt, kas te ir domāts ar "saistīto stāvokli", jo ja runa ir par ķīmiskajām saitēm, tad autors laikam ir nobastojis to ķīmijas stundu, kurā stāstīts par sārmiem. Nu, tiem, kas satur (OH)- jonu, proti, tādu, kurā skābeklis ir saistītā stāvoklī ar ūdeņraža atomu. Vai to ķīmijas stundu, kurā ir stāstīts par skābekli nesaturošām skābēm. Vai to ķīmijas stundu, kurā stāstīts jebkas par skābekli. Vai, būsim atklāti, ķīmiju kā mācību priekšmetu. Arī "sārmainie mikroelementi" diez cik sārmaini nebūs - organismā šie mēdz būt pozitīvi jonizētā formā, un līdz ar to, tikpat pozitīvu ūdeņraža jonu neņems pretī.
"Arī sirds infarkts un insults rodas, kad organismā ir skāba iekšējā vide. Skābās asinīs eritrocīti – sarkanie asins ķermenīši kļūst stīvi, tie nespēj mainīt savu formu, iesprūstot sīkajos kapilāros, tos aizsprostojot."
Lai gan pastāv slimība, kuras ietvaros eritrocīti kļūst stīvi un lipīgi, un nosprosto asinsvadus, tai nav nekāda sakara ar skābu vidi (atgādināšu, ka asins pH dzīvam cilvēkam nemaz nespēj sasniegt skābu vērtību).
"Jau 30 gados tika pierādīts, ka vēža rašanās process ir anaerobs (bez skābekļa)."
Nē, tā gluži vienkārši nav taisnība. Ir konstatēts, ka audzējos ir skābekļa bads, bet tās ir sekas, nevis cēlonis.
"Kamēr skābes nav neitralizētas, tās bojā asinsvadus, piemēram, pienskābe izēd caurumus artērijās un organisms liek plāksterus no zema blīvuma lipoproteīdiem (holesterīna), lai novērstu asiņošanu. Tātad reālais vaininieks ir skābe."
Izklausās pēc kaut kādas multenītes sižeta (kaut kas līdzīgs tām, kuras agrāk rādīja zobupastu reklāmās, ar skāboņiem un zobgraužiem...), bet dabā, ja vien kāds nav izdomājis injicēt asinīs pienskābi, kurā gadījumā holesterīna plāksterīši būtu mazākā problēma, pienskābe asinīs nevar sasniegt tādu koncentrāciju, lai būtu kaut cik korozīva.
" Ir pierādīts, ka akmeņi nierēs un žultspūslī sastāv no jūsu kaulu kalcija, bet ne no kalcija, ko mēs organismā uzņemam ar uzturu."
Žēl, ka nav atsauces uz kādu avotu - mani tiešām ieinteresēja jautājums, kā šito vispār varētu teorētiski izpētīt. Vienīgā versija - barot cilvēku ar pārtiku, kas bagātināta ar kādu kalcija izotopu, un tad cerēt, ka viņš kaut kad dabūs nierakmeņus. Bet tad kaulos gan jau ka arī notiktu kaut kāda bagātināšanās ar "iebaroto" izotopu... Hm. Katrā ziņā, apstiprinājumu šādam apgalvojumam neatradu.
Tālāk seko sarakstiņš ar skābēm, un to avotiem. Interesants.
"Sālsskābe – no stresa, bailēm, dusmām" Un no tā, ka ir kuņģis.
"Etiķskābe – no saldumiem un taukiem." Nu, jā, ja ar to saprot VISUS ogļhidrātus un VISUS taukus. Redz, etiķskābe (precīzāk, acetātjons) rodas normālā vielmaiņas procesā. Ko darīt? Es rekomendēju neko, jo organisms tā ir uzbūvēts, ka tiek ar etiķskābi galā bez sevišķām problēmām. Nav ko celt paniku.
"Nikotīnsskābe – no smēķēšanas" Kā arī no veselīga uztura. Tiem, kas nezināja - nikotīnskābi biežāk pieņemts saukt par vitamīnu B3. Nu, un rakstīt ar vienu "s".
Šajā rakstā vairs nekā interesanta, tikai slimību, kuras izraisa skābes, saraksts, kas pārsteidzošā kārtā ietver sevī praktiski visu, kas vien cilvēkam var piemesties.
Par laimi, es netīšām nonācu arī sadaļā par uzturu. Autors turpina sajūsmināt.
"...uzturam jābūt dzīvam, tādam, kas satur saules fotonu enerģiju (audzēts atklātā laukā), jo stikls vai plēve aiztur fotonu plūsmu."
Domāju, komentārus neprasa.
"Zaļie augi.
Hemoglobīns ir tiešā hlorofila kopija. Tā molekula sastāv no 514 aminoskābēm un 4 dzelzs atomiem. Šķīdumā dzelzs izskatās sarkana. Līdzīgs sastāvs ir hlorofilam - 514 aminoskābes un 4 magnija atomi. Šķīdumā magnijs izskatās zaļš. Ar B12 vitamīna starpniecību caur kobaltu, nomainot 4 dzelzs atomus ar 4 magnija atomiem, zaļā augu sula - augu asinis pārtop par cilvēka asinīm."
Nedomāju, ka cilvēks spēj būt tādā pālī, lai noturētu hlorofilu par hemoglobīna kopiju, vai otrādi. Hemoglobīns satur nedaudz vairāk, nekā apgalvots, proti, 574 aminoskābes. Un jā, četrus dzelzs atomus. Hlorofils, savukārt, satur nedaudz mazāk aminoskābju, nekā apgalvots, proti, 0. Un vienu magnija atomu. Līdzīgs ir tikai to metālu kompleksējošais centrs, pārējie fragmenti šīm molekulām ir ārkārtīgi atšķirīgi. Tāpat arī "caur kobaltu nomainīt dzelzi ar magniju" īsti nesanāks. Kaut vai tādēļ, ka šis teikums pats par sevi ir nesakarīgs - vai tur tiek apgalvots, ka apēdot jebko hlorofilu saturošu, organismā norisinās kodolreakcija? Zinot autora izpratni par ķīmiju, es pārsteigts nebūtu.
Ā, un par tām metālu krāsām šķīdumā - nē. Dzelzs ta vēl tā, var šādas tādas krāsas parādīt, bet magnija jons šķīdumā ir bezkrāsains. Zaļa ir visa hlorofila molekula kopumā, nevis magnijs pats par sevi.
"Ar ko dabīgie vitamīni atšķiras no sintētiskajiem?
Vitamīni tie ir vitālie amīni. To sastāvā ir mikroelementi un aminoskābes. Aminoskābju sastāvā ir nukleīnskābes DNS un RNS."
Re, kur var apskatīties, kā izskatās nukleīnskābju formula.
Aminoskābes, savukārt, izskatās šitā.
Tā kā, nē, visas tās vienkāršās un mazās aminoskābes nesastāv vis no milzīgajām, komplicētajām nukleīnskābēm. Vēl jo vairāk, tām pat nav kopīgu struktūras elementu.
"Dzīvajās šūnās DNS molekulas spirāle ir sagriezta uz kreiso pusi. Ja arī ķīmiskās sintēzes ceļā izdodas iegūt kādas vielas molekulu ar vajadzīgo elementu skaitu, tomēr telpisko konfigurāciju atveidot izdodas reti. Mākslīgi iegūto vitamīnu molekula visbiežāk nav sagriezta vispār vai arī ir uz labo pusi."
Lasot šo, gar logu pabrauca trolejbuss, un es jutu, kā māja nodreb. Tas palīdzēja iztēlei - jo izlasot par "reto telpiskās konfigurācijas atveidošanu", spēju gluži dzīvi iztēloties visus tos ķīmiķus, kas vai ta nu kapā rotēja, vai urbās ārā, jo nespēja mierīgi nogulēt, šitādus zaimus dzirdot. Galu galā, par telpiskās konfigurācijas maiņu zināja jau 19. gs. beigās. Rīgā vēl ir tāds smuks molekulārs piemineklis par godu Paulam Valdenam, kurš še strādādams, atklāja reakciju, kas pazīstama kā Valdena apgriezenība. Ja tā raksta autoram ir pārāk sena vēsture, varbūt derētu apskatīties, par ko piešķirta 2001. gada Nobela prēmija ķīmijā? Šie ķīmiķi pat nav jārok ārā, viņi joprojām steberē pa šo pasauli, un sintezē vielas ar tādu telpisko struktūru, kāda nu šiem kurā gadījumā vajadzīga, un ne viņi vienīgie. Par to "struktūra nav sagriezta vispār" - ne jau no ķīmiķa tas ir atkarīgs. Ja molekulā ir kāds asimetrisks atoms, tad tas ir asimetrisks, un viss. Uz kādu no pusem jau tas būs pagriezts (piebildīšu, ka runāt par "labo" vai "kreiso" pusi molekulai ir muļķīgi, jo to var uzzīmēt, kā ienāk prātā. Asimetrisku atomu telpiskās konformācijas nosaukšanai ir izstrādāti īpaši noteikumi, kuru uzskaitīšana pagarinātu šo jau tā garo tekstu līdz nenormālam palagam), un ļaunākajā gadījumā iegūtajā vielā puse molekulu būs "pagrieztas" uz vienu pusi, un puse - uz otru. Arī tā nav liela nelaime - pastāv metodes šādu dažādas telpiskās konformācijas molekulu atdalīšanai, un pēc tam tai pusei, kas ir ar "nepareizo" konformāciju, reizēm iespējams veikt stereocentra inversiju. Gadās, protams, arī problemātiskāki gadījumi, bet visā visumā ir muļķīgi apgalvot, ka nav iespējams mākslīgi radīt dabas vielas ar nepieciešamo telpisko konformāciju. Savulaik Vudvarda B12 vitamīna sintēze tika uzskatīta par pierādījumu, ka nav tādas molekulas, kuru būtu pārāk sarežģīti uzsintezēt - un tajā vitamīnā ir 9 stereocentri. Un ikkatrs no tiem ir "pagriezts pareizi". Turklāt tas bija septiņdesmitajos, kad daudzi instrumenti un metodes, kas šo uzdevumu mūsdienās atvieglo, nebija izgudroti un/vai ieviesti plašākā lietošanā.
"Hidrogenētie tauki.
Nepiesātinātajās augu tauku molekulās, to brīvajās vietās liela spiediena ietekmē tiek iespiestas ūdeņraža molekulas un tie kļūst par piesātinātiem taukiem, kas ir veselībai kaitīgi, varētu teikt, ka, ilgstoši lietojot pat bīstami."
Tātad, visas tās ķīmijas "gudrības" ir rakstījis cilvēks, kurš uzskata, ka ūdeņraža molekulas var iespiest citu molekulu "brīvajās vietās"... Nu, nebūs tā. Process ir bišku sarežģītāks, un notiek uz katalizatora virsmas, veidojoties jaunām saitēm starp atomiem. Lai gan sīkumos neizskaidro, man likās, ka to tak vidusskolā māca?
"Kā izejviela pārsvarā tiek izmantota lētā palmu un kokosriekstu eļļa. Hidrolizējot to, var iegūt ērtu konsistenci un ilgu uzglabāšanas termiņu."
Autoram arī kāds nav izskaidrojis, ka "hidrolizēt" un "hidrogenēt" ir divas dažādas lietas. Bet nu, patīk tak tie gudrie vārdiņi, patīk...
"Ir vēl viens hidrogenēto tauku veids, kurš nav pieskaitāms ne pie piesātinātiem, ne pie nepiesātinātiem taukiem. Tās ir transtaukskābes. Ūdeņraža atomi cauri tauku molekulai augstas temperatūras iedarbībā tiek transportēti uz otru pusi jaunā vietā, un veidojas otrādi sagriezta tauku molekulu konstrukcija."
1) Ir gan pieskaitāms - lai runātu par trans konformāciju, ir nepieciešama dubultsaite. Un ja taukskābē ir dubultsaite, tad tā pieder pie nepiesātinātajām.
2) Cauri molekulai transportēt ūdeņradi vis nesanāks, tas mehānisms ir pilnīgi citādāks. Ne vienmēr augstā temperatūrā tas notiek, starp citu.
3) Tas nav "hidrogenēto tauku veids", bet gan hidrogenēšanas blakusprodukts, pie kam, iespējams, ka hidrogenēšanas procesā trans-taukskābju paliek mazāk - kā nekā, hidrogenējot dubultsaites kļūst par vienkāršajām, un ja nav dubultsaites, tad nav iespējama trans-konformācija.
Eh. Piekusu, taisnību sakot. Gan jau, ka pa sadaļām skatoties, varētu atrast vēl, vēl un vēl visādu murgu, bet ir jau vēls, un tā. Interesanti, protams, palasīt rakstu, kur kāds ar ķīmiju ne visai pazīstams cilvēks izdomājis lietot aplam daudz ķīmisku terminu, taču tajā pašā laikā - tā skumīgi mazliet. Ņemot vērā, ka ar ķīmiju saistītu interneta resursu latviešu valodā nav īpaši daudz, skumji redzēt, ka šāda apjoma it kā informatīvs materiāls ir būtībā caurcaurēm absurds. |
|